发布时间:2024-07-31 人气:2566 作者:
在全球医疗器械领域,印度尼西亚作为东南亚地区的重要市场,对医疗器械制造商而言是一个不可忽视的机遇。本指南将为医疗器械制造商提供详尽的印度尼西亚市场准入策略,确保产品合规并顺利进入市场。
监管机构
印尼的医疗器械由印度尼西亚共和国卫生部(MOH)下属--国家药品和食品控制局(NADFC)监管。
主要法规
医疗器械法规(Regulation No. 62 of 2017)
参考法规
东盟医疗器械指令(ASEAN Medical Device Directive)
医疗器械风险分类
根据风险等级,医疗器械/IVD分为以下几类:
Class A:低风险
Class B:低到中风险
Class C:中到高风险
Class D:高风险
官方费用
印度尼西亚的注册费从A类的约115美元到D类的约340美元不等。
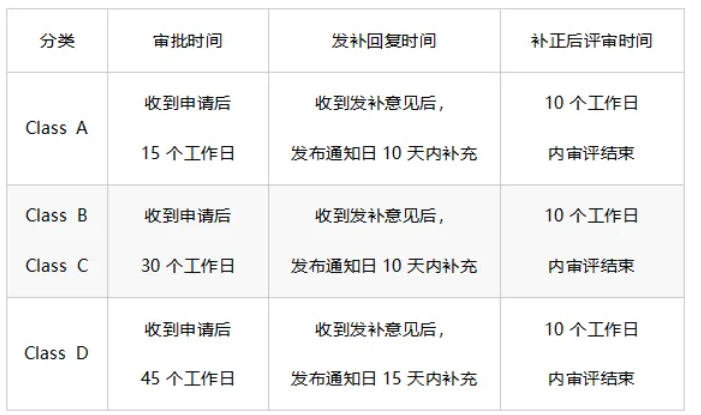
审批时间
申请资料
申请表
生产许可/进口许可证(申请人)
授权书
FSC
ISO13485
说明书、标签
风险管理
……
注册申请流程
通过印度尼西亚医疗器械集中网上申请系统提交,简化注册过程。
注册证有效期
注册成功后,医疗器械注册证书有效期最长为5年。
授权书的有效期最短为2年,最长为5年。该有效期的持续时间也将决定医疗器械注册证书的有效期。
语言要求
通常情况下,注册资料仅需以英文提供,但若产品的使用对象是公众,部分文件可能需要同时以印度尼西亚语提供。
注册资格
任何希望将产品进口到印度尼西亚的公司都必须首先通过在线单一提交(OSS)系统进行注册,以获得作为基本进口许可证的商业识别号(NIB)。
💡请注意,只有印尼当地公司才能(通过OSS)申请NIB和医疗器械经销许可证IDAK(Izin Distribusi Alat Kesehatan),从而注册和进口医疗器械。
外国制造商必须在印尼指定一位授权代表(当地实体公司,且拥有印尼卫生部颁发的医疗器械经销商许可证);
同类产品只能指定一位授权代表,不得为同一设备任命多名国内代表;
外国制造商必须签发一份公司信笺上的授权书(LoA),由公司高管签字并盖章,授权国内代表注册医疗器械。且授权书LoA必须由当地印尼大使馆认证。
证书转让
产品许可证,经新旧代理双方同意,可以从一个授权代表转移到另一个,确保业务连续性和合规性。如果对方不配合,新的申请需等6个月再提交。
医疗器械注册流程概述
1. 确定产品是否属于医疗器械及风险分类。
2. 指定印度尼西亚法定代表。
3. 准备注册文件。
4. 提交注册文件至申报系统。
5. 获取医疗器械注册证书。
6. 合法进入印度尼西亚市场销售。





