《关于优化审评审批服务推动创新药械使用促进医药产业高质量发展行动方案(2022-2024年)》政策解读正式出台《关于优化审评审批服务推动创新药械使用促进医药产业高质量发展行动方案(2022-2024年)》
围绕积极践行“争当表率、争做示范、走在前列”光荣使命,深入贯彻落实省第十四次党代会决策部署,推动医药产业创新提质增效,提出了一系列有针对性和可操作性的工作举措,着力促进我省打造全国领先、全球有影响力的医药产业高地。现就《行动方案》有关内容解读如下:
不限 NMPA 广东省 江苏省 浙江省 上海市 北京市 安徽省 河北省 山西省 吉林省 辽宁省 黑龙江省 陕西省 甘肃省 青海省 山东省 福建省 台湾省 河南省 湖北省 湖南省 江西省 海南省 四川省 贵州省 云南省 天津市 重庆市
不限 2024 2023 2022 2021 2020 2019 2018 2017 2016 2015 2014 2013 2012 2011 2010 2009 2008 2007 2006

围绕积极践行“争当表率、争做示范、走在前列”光荣使命,深入贯彻落实省第十四次党代会决策部署,推动医药产业创新提质增效,提出了一系列有针对性和可操作性的工作举措,着力促进我省打造全国领先、全球有影响力的医药产业高地。现就《行动方案》有关内容解读如下:

从事第二类、第三类医疗器械生产活动,应当经所在地省、自治区、直辖市药品监督管理部门批准,依法取得医疗器械生产许可证;从事第一类医疗器械生产活动,应当向所在地设区的市级负责药品监督管理的部门办理医疗器械生产备案。

从事医疗器械经营活动,应当遵守法律、法规、规章、强制性标准和医疗器械经营质量管理规范等要求,保证医疗器械经营过程信息真实、准确、完整和可追溯。
医疗器械注册人、备案人可以自行销售,也可以委托医疗器械经营企业销售其注册、备案的医疗器械。

国家药品监督管理局会同国家卫生健康委员会组织修订了《医疗器械临床试验质量管理规范》,现予发布,自2022年5月1日起施行


已有525次查看

已有460次查看
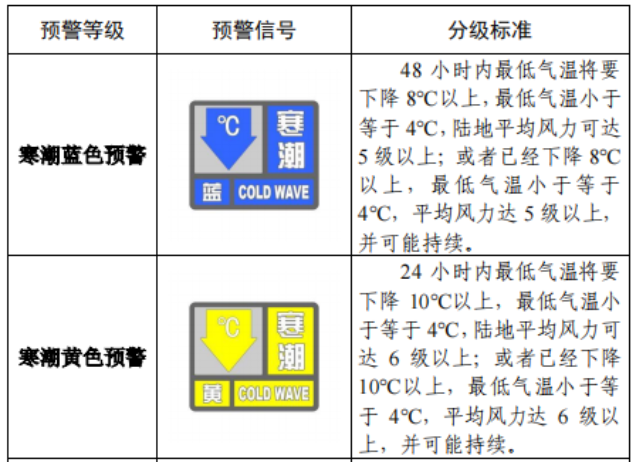
已有492次查看
已有471次查看

已有490次查看

已有590次查看

已有484次查看
已有470次查看
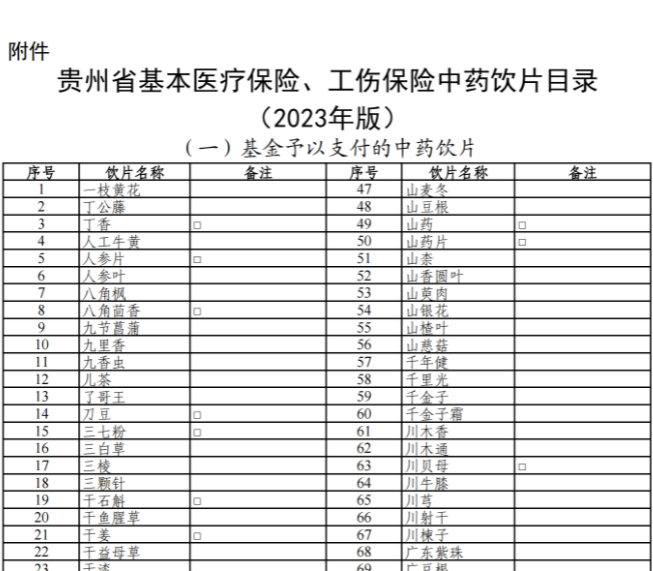
已有467次查看

已有459次查看





