关于印发江苏省医疗器械生产分级监管实施办法的通知(有效)是指根据医疗器械的风险程度以及医疗器械注册人备案人、受托生产企业的质量管理水平
结合医疗器械不良事件、企业监管信用及产品质量投诉状况等因素,将医疗器械注册人备案人、受托生产企业分为不同的级别,按照风险分级、科学监管,全面覆盖、动态调整,落实责任、提升效能的原则,实施属地化分级动态管理的活动。
不限 NMPA 广东省 江苏省 浙江省 上海市 北京市 安徽省 河北省 山西省 吉林省 辽宁省 黑龙江省 陕西省 甘肃省 青海省 山东省 福建省 台湾省 河南省 湖北省 湖南省 江西省 海南省 四川省 贵州省 云南省 天津市 重庆市
不限 2024 2023 2022 2021 2020 2019 2018 2017 2016 2015 2014 2013 2012 2011 2010 2009 2008 2007 2006

结合医疗器械不良事件、企业监管信用及产品质量投诉状况等因素,将医疗器械注册人备案人、受托生产企业分为不同的级别,按照风险分级、科学监管,全面覆盖、动态调整,落实责任、提升效能的原则,实施属地化分级动态管理的活动。

围绕积极践行“争当表率、争做示范、走在前列”光荣使命,深入贯彻落实省第十四次党代会决策部署,推动医药产业创新提质增效,提出了一系列有针对性和可操作性的工作举措,着力促进我省打造全国领先、全球有影响力的医药产业高地。现就《行动方案》有关内容解读如下:

1.《医疗器械监督管理条例》(中华人民共和国国务院令第 650号)
2.《医疗器械注册管理办法》(国家食品药品监督管理总局令第 4号第三十四条、第五十一条)
3.《体外诊断试剂注册管理办法》(国家食品药品监督管理总局令第 5号第四十四条、第六十三条)
4.《国家食品药品监督管理总局关于发布医疗器械生产质量管理规范的公告》( 2014年第64号)
5.《国家食品药品监督管理总局关于发布医疗器械生产质量管理规范附录无菌医疗器械的公告》( 2015年第101号)

根据《网格监管团队“下沉两级”工作制度(试行)》,建立由省、市县(市、区) 监管人员组成的监管团队名单。
组织监管团队开展现场检查,在检查记录表中如实记录现场检查发现的问题。

检查结束时向企业通报检查情况,并由企业负责人在检查记录表上签字确认。检查组撰写检查报告,检查报告如实反应检查全部真实情况处室汇总整理检查记录和检查报告,讨论研究检查结果处理。

为贯彻落实《国务院关于改革药品医疗器械审评审批制度的意见》(国发〔2015〕44号)以及国务院有关行政审批制度改革精神,进一步加强医疗器械注册管理,切实提高审评审批效率,经国家食品药品监督管理总局局务会议研究决定,将下列由国家食品药品监督管理总局作出的医疗器械行政审批决定,调整为由国家食品药品监督管理总局医疗器械技术审评中心以国家食品药品监督管理总局名义作出:

对保障人体健康和生命安全的技术要求,应当制定为医疗器械强制性国家标准和强制性行业标准。对满足基础通用、与强制性标准配套、对医疗器械产业起引领作用等需要的技术要求,可以制定为医疗器械推荐性国家标准和推荐性行业标准。

国家食品药品监督管理总局负责指导全国医疗器械网络销售、医疗器械网络交易服务的监督管理,并组织开展全国医疗器械网络销售和网络交易服务监测。省级食品药品监督管理部门负责医疗器械网络交易服务的监督管理。


已有522次查看

已有458次查看
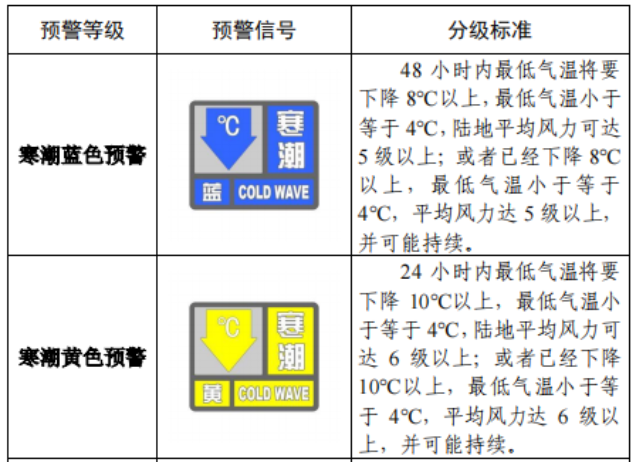
已有488次查看
已有470次查看

已有488次查看

已有588次查看

已有482次查看
已有467次查看
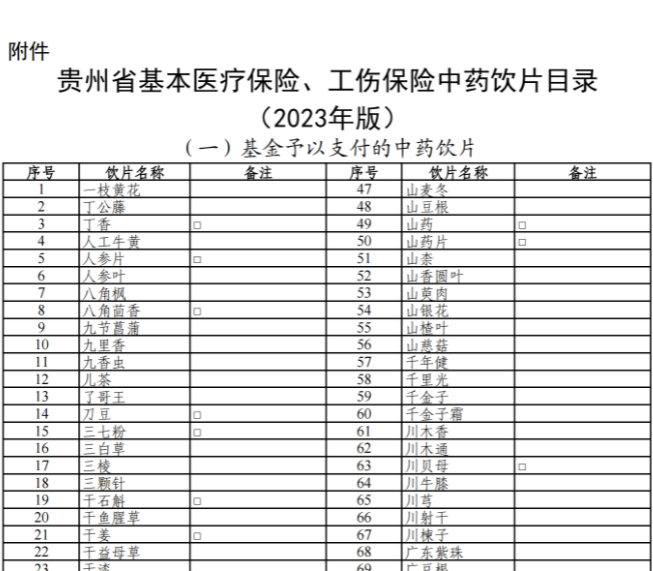
已有465次查看

已有458次查看





