医疗器械PMDA注册究竟是什么?医疗器械PMDA注册对产品的技术和质量要求非常高,需要申请人具备完善的技术和质量管理体系。
医疗器械PMDA注册是指在日本厚生劳动省进行医疗器械上市前申请的过程。PMDA是日本厚生劳动省的英文缩写,负责监管日本的医疗器械市场,对医疗器械的上市前申请进行审批。
不限 2024 2023 2022 2021 2020 2019 2018 2017 2016 2015 2014 2013 2012 2011 2010 2009 2008 2007 2006

医疗器械PMDA注册是指在日本厚生劳动省进行医疗器械上市前申请的过程。PMDA是日本厚生劳动省的英文缩写,负责监管日本的医疗器械市场,对医疗器械的上市前申请进行审批。

医疗器械临床CRO的首要职责是根据医疗器械的特点和目标,设计科学、严谨、可行的临床试验方案。试验方案包括试验目的、试验设计、样本量、观察指标、数据分析方法等。

创新医疗器械注册需要提交完整的注册申请资料,包括产品技术文件、质量管理体系文件、临床试验报告等。这些资料必须真实、准确、完整,才能够通过监管部门的审查。

在欧亚联盟内进行医疗器械注册,企业需要向所在国家的监管部门提交申请材料。这些材料包括医疗器械的技术文件、质量管理体系文件、临床试验报告等。

有一家叫NORDSON Medical (诺信医学)的创新公司和一家叫XPAN(艾克斯畔)的创新公司在穿刺器的创新方面提供了两种不同的新方向,其中Nordson medical创新地将临床刚需的全分离式穿刺器+可视性的穿刺锥+为解决临床筋膜缝合的痛点而诞生的筋膜闭合器做了一个非常巧妙的集成设计,解决了临床中确切的痛点,进行了比较大的创新,发明了一款叫一次性套管穿刺器型筋膜闭合器。

外资企业在相当长的时间中几乎垄断了内窥镜市场,产品得到等级医院的充分认可。不过,近年来国内企业在内窥镜赛道持续发力,市场份额显著提升。

该产品由单光子发射计算机断层扫描系统(SPECT)主机(含两个SPECT探测器)、CT主机架、检查床、PDU服务器、采集客户端工作站、SPECT采集服务器工作站、CT采集重建工作站、影像处理工作站、患者定位监视器、SPECT准直器等组成。

FDA批准的Paradise™系统预期用途声明该系统适用于生活方式改变和药物不足以控制血压的患者。Paradise™系统使用超声波能量来干扰来自交感神经的信号,其治疗机制与美敦力(Medtronic)使用射频能量的Symplicity Spyral略有不同,Symplicity Spyral已经于2013年获得了CE。


已有398次查看

已有346次查看
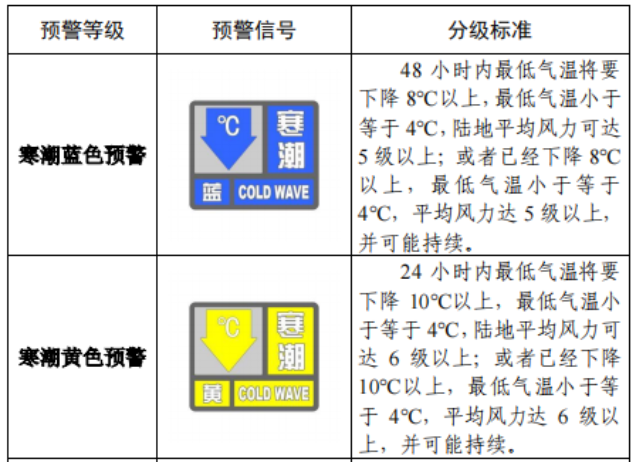
已有373次查看
已有359次查看

已有373次查看

已有473次查看

已有373次查看
已有355次查看
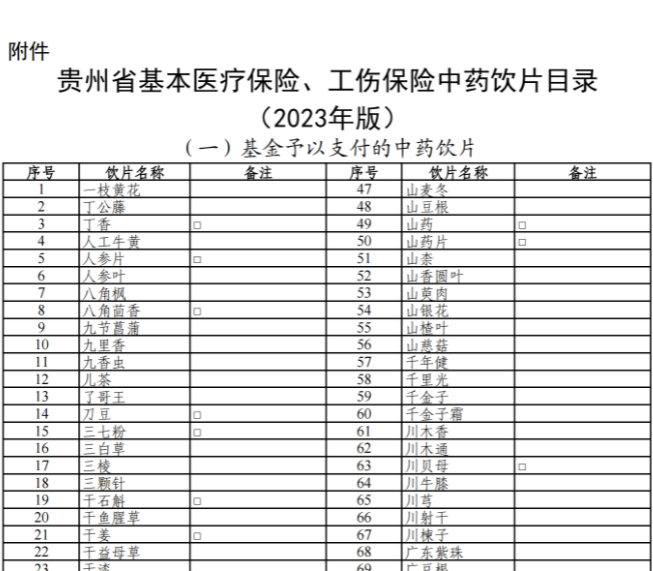
已有354次查看

已有343次查看





