印度(India)医疗器械注册要点(流程、费用及时间)C、D类产品必须在印度境内进行临床试验,除非有认可国家/地区(欧盟、美国、日本、加拿大、澳大利亚)发出的自由销售证明。
境外生产商首先需要指定印度境内的代理持证人,角色包含总代、注册代理等,直接与CDSCO沟通注册等事宜。代理持证公司具体收费(代持证书费用、进口业务费用等)自定。代理持证人必须持有有效的批发许可证(表格20B和21B / 21C)。

境外生产商首先需要指定印度境内的代理持证人,角色包含总代、注册代理等,直接与CDSCO沟通注册等事宜。代理持证公司具体收费(代持证书费用、进口业务费用等)自定。代理持证人必须持有有效的批发许可证(表格20B和21B / 21C)。

2023年10月,广东省药品监督管理局共批准注册第二类医疗器械产品250个,其中首次注册161个,延续注册89个(具体产品见附件)。

医疗器械PMDA注册是指在日本厚生劳动省进行医疗器械上市前申请的过程。PMDA是日本厚生劳动省的英文缩写,负责监管日本的医疗器械市场,对医疗器械的上市前申请进行审批。


已有1392次查看

已有1238次查看
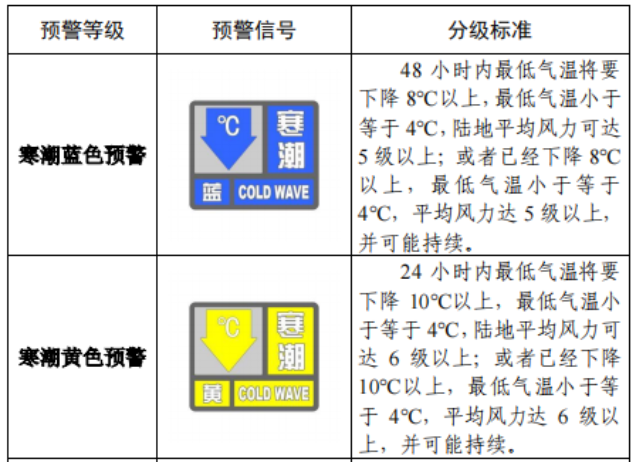
已有1214次查看
已有1193次查看

已有1197次查看

已有1237次查看

已有1241次查看
已有1212次查看
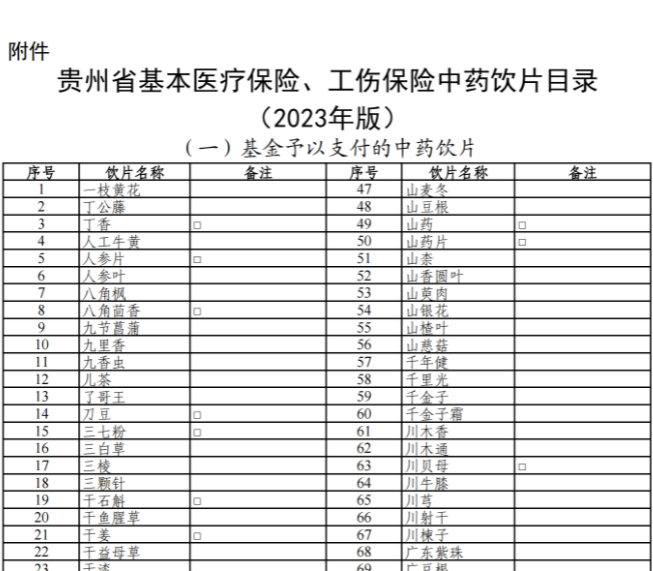
已有1224次查看

已有1136次查看





