医疗器械不良事件监测和再评价管理办法(国家市场监督管理总局令第1号)《医疗器械不良事件监测和再评价管理办法》已经国家市场监督管理总局和国家卫生健康委员会审议通过,现予公布,自2019年1月1日起施行。
应当具有保证医疗器械安全有效的质量管理能力和相应责任能力,建立医疗器械不良事件监测体系,向医疗器械不良事件监测技术机构(以下简称监测机构)直接报告医疗器械不良事件。由持有人授权销售的经营企业、医疗器械使用单位应当向持有人和监测机构报告医疗器械不良事件。
不限 NMPA 广东省 江苏省 浙江省 上海市 北京市 安徽省 河北省 山西省 吉林省 辽宁省 黑龙江省 陕西省 甘肃省 青海省 山东省 福建省 台湾省 河南省 湖北省 湖南省 江西省 海南省 四川省 贵州省 云南省 天津市 重庆市
不限 2024 2023 2022 2021 2020 2019 2018 2017 2016 2015 2014 2013 2012 2011 2010 2009 2008 2007 2006

应当具有保证医疗器械安全有效的质量管理能力和相应责任能力,建立医疗器械不良事件监测体系,向医疗器械不良事件监测技术机构(以下简称监测机构)直接报告医疗器械不良事件。由持有人授权销售的经营企业、医疗器械使用单位应当向持有人和监测机构报告医疗器械不良事件。

医疗器械广告的内容应当以药品监督管理部门批准的注册证书或者备案凭证、注册或者备案的产品说明书内容为准。医疗器械广告涉及医疗器械名称、适用范围、作用机理或者结构及组成等内容的,不得超出注册证书或者备案凭证、注册或者备案的产品说明书范围。

国家药品监督管理局主管全国医疗器械注册与备案管理工作,负责建立医疗器械注册与备案管理工作体系和制度,依法组织境内第三类和进口第二类、第三类医疗器械审评审批,进口第一类医疗器械备案以及相关监督管理工作,对地方医疗器械注册与备案工作进行监督指导。

从事医疗器械经营活动,应当遵守法律、法规、规章、强制性标准和医疗器械经营质量管理规范等要求,保证医疗器械经营过程信息真实、准确、完整和可追溯。
医疗器械注册人、备案人可以自行销售,也可以委托医疗器械经营企业销售其注册、备案的医疗器械。

国家药品监督管理局会同国家卫生健康委员会组织修订了《医疗器械临床试验质量管理规范》,现予发布,自2022年5月1日起施行


已有525次查看

已有460次查看
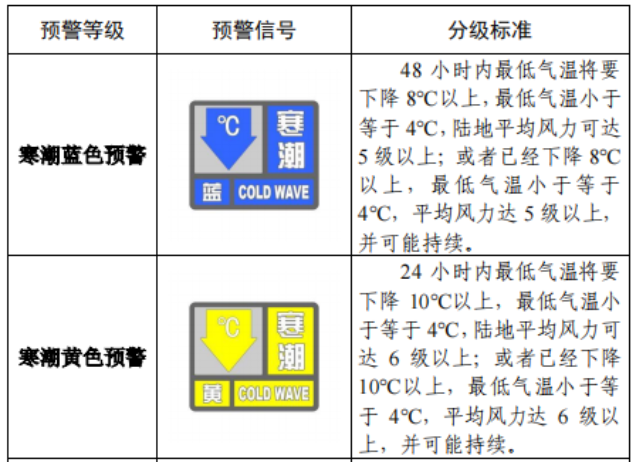
已有492次查看
已有471次查看

已有490次查看

已有590次查看

已有484次查看
已有470次查看
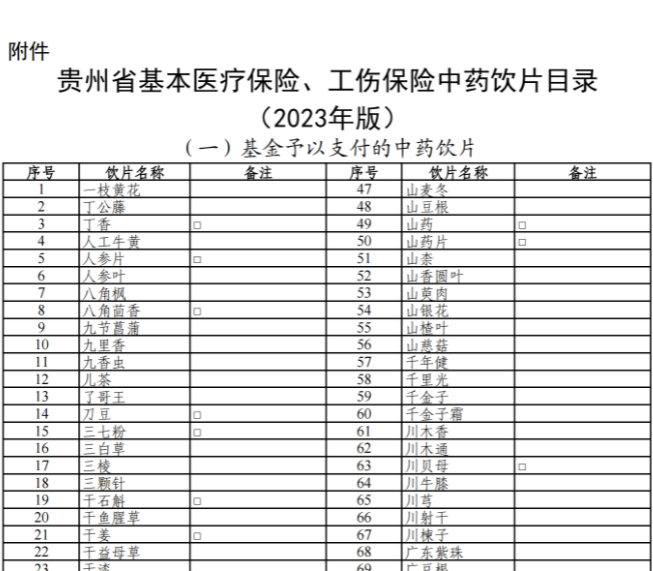
已有467次查看

已有459次查看





