河南省第二类医疗器械注册证遗失补办
《医疗器械注册管理办法》第四十五条、《体外诊断试剂注册管理办法》第五十四条:医疗器械注册证遗失的,注册人应当立即在原发证机关指定的媒体上登载遗失声明。自登载遗失声明之日起满1个月后,向原发证机关申请补发,原发证机关在20个工作日内予以补发。
不限 NMPA 广东省 江苏省 浙江省 上海市 北京市 福建省 天津市 重庆市 河北省 山西省 吉林省 辽宁省 黑龙江省 陕西省 甘肃省 青海省 山东省 台湾省 河南省 湖北省 湖南省 江西省 安徽省 海南省 四川省 贵州省 云南省

《医疗器械注册管理办法》第四十五条、《体外诊断试剂注册管理办法》第五十四条:医疗器械注册证遗失的,注册人应当立即在原发证机关指定的媒体上登载遗失声明。自登载遗失声明之日起满1个月后,向原发证机关申请补发,原发证机关在20个工作日内予以补发。

1、《医疗器械监督管理条例》(中华人民共和国国务院令第739号)第十三条:“……,第二类、第三类医疗器械实行产品注册管理”;第十六条:“申请第二类医疗器械产品注册,注册申请人应当向所在地省、自治区、直辖市人民政府药品监督管理部门提交注册申请资料。……”。第二十一条:“……发生其他变化的,应当按照国务院药品监督管理部门的规定备案或者报告”

1、《医疗器械监督管理条例》(中华人民共和国国务院令第739号)第十三条:“……,第二类、第三类医疗器械实行产品注册管理”;第十六条:“申请第二类医疗器械产品注册,注册申请人应当向所在地省、自治区、直辖市人民政府药品监督管理部门提交注册申请资料。……”。第二十一条:“已注册的第二类、第三类医疗器械产品,其设计、原材料、生产工艺、适用范围、使用方法等发生实质性变化,有可能影响该医疗器械安全、有效的,注册人应当向原注册部门申请办理变更注册手续;……”

《医疗器械监督管理条例》(2000年1月4日国务院令第276号,2014年3月7日予以修改)第十一条:申请第二类医疗器械产品注册,注册申请人应当向所在地省、自治区、直辖市人民政府食品药品监督管理部门提交注册申请资料。……

1、《医疗器械监督管理条例》(中华人民共和国国务院令第739号)第十六条:“申请第二类医疗器械产品注册,注册申请人应当向所在地省、自治区、直辖市人民政府药品监督管理部门提交注册申请资料。……”。

国家食品药品监督管理总局关于发布医疗器械注册证补办程序等5个相关工作程序的通告(2015年第91号) 附件2《医疗器械注册证纠错程序》:“对于下列原因造成的错误,可以提出对注册证及其附件内容纠错申请:(一)注册证、变更文件及其附件打印错误。(二)注册证编号错误。(三)企业填报错误。(四)审评、审批工作中出现的其他错误。”

1.《中华人民共和国药品管理法》第二十五条 ……国务院药品监督管理部门在审批药品时,对化学原料药一并审评审批,对相关辅料、直接接触药品的包装材料和容器一并审评,对药品的质量标准、生产工艺、标签和说明书一并核准。……
2.《中华人民共和国药品管理法实施条例》第三十五条 申请进口的药品,应当是在生产国家或者地区获得上市许可的药品;未在生产国家或者地区获得上市许可的,经国务院药品监督管理部门确认该药品品种安全、有效而且临床需要的,可以依照《药品管理法》及本条例的规定批准进口。进口药品,应当按照国务院药品监督管理部门的规定申请注册。国外企业生产的药品取得《进口药品注册证》,中国香港、澳门和台湾地区企业生产的药品取得《医药产品注册证》后,方可进口。
3.《中华人民共和国药品管理法》第二十四条 在中国境内上市的药品,应当经国务院药品监督管理部门批准,取得药品注册证书……
4.《中华人民共和国疫苗管理法》第十九条 在中国境内上市的疫苗应当经国务院药品监督管理部门批准,取得药品注册证书;申请疫苗注册,应当提供真实、充分、可靠的数据、资料和样品。对疾病预防、控制急需的疫苗和创新疫苗,国务院药品监督管理部门应当予以优先审评审批。

根据原国家食品药品监督管理总局《关于药物临床试验信息平台的公告》(2013年第28号)第一项要求,凡获国家食品药品监督管理总局临床试验批件并在我国进行临床试验(含生物等效性试验、PK试验、I、Ⅱ、Ⅲ、Ⅳ期试验等)的,均应登陆信息平台(网址:www.cde.org.cn),按要求进行临床试验登记与信息公示。


已有1777次查看

已有1423次查看

已有1366次查看

已有1391次查看
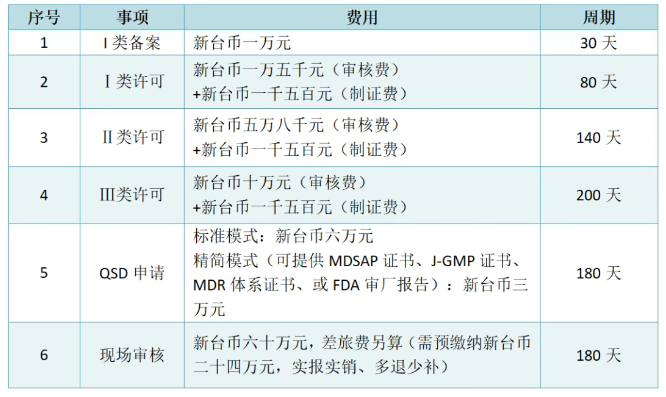
已有772次查看
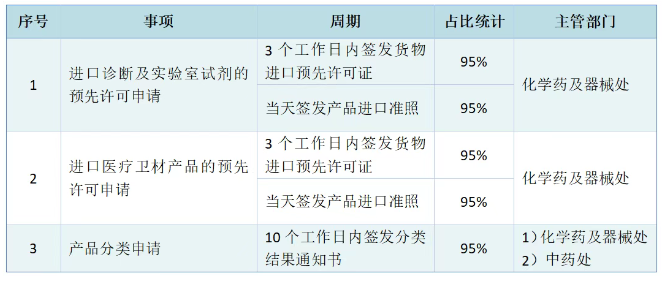
已有642次查看

已有723次查看

已有1154次查看

已有606次查看

已有551次查看

已有708次查看

已有637次查看

已有570次查看

已有647次查看
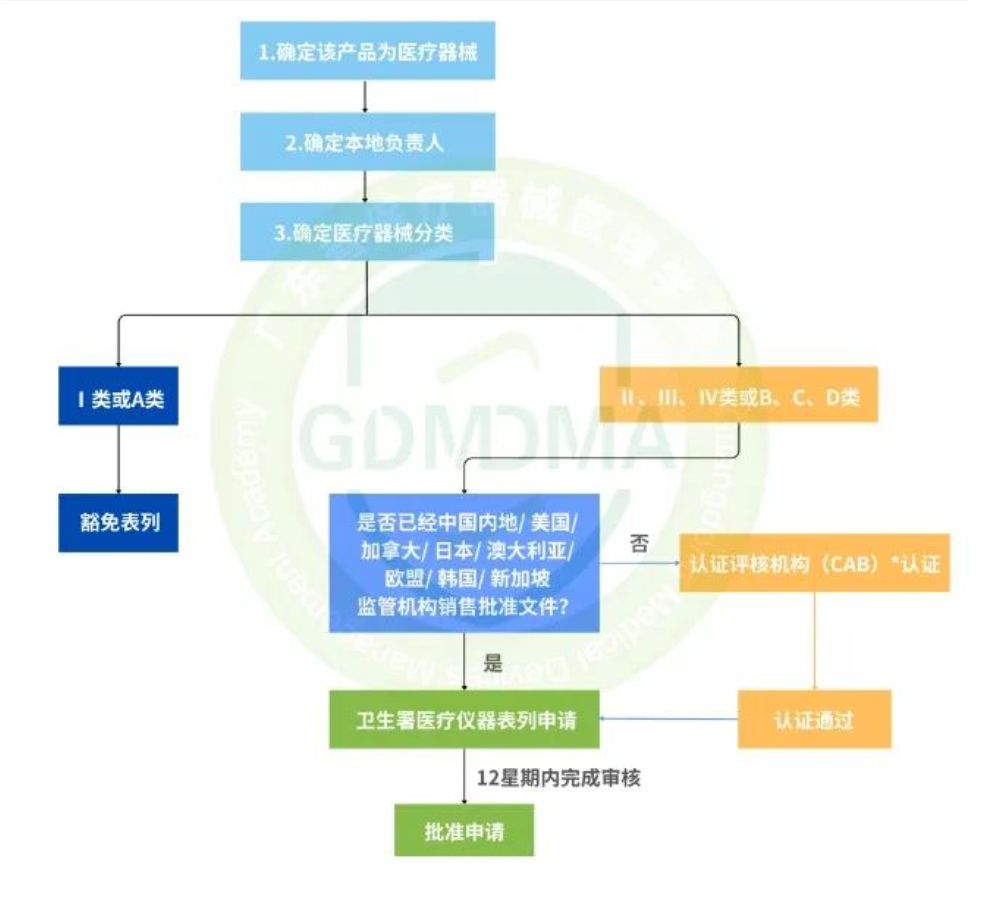
已有977次查看





