上海市第二类体外诊断试剂首次注册上海市药品监督管理局
中华人民共和国国务院令第739号《医疗器械监督管理条例》第十六条 申请第二类医疗器械产品注册,注册申请人应当向所在地省、自治区、直辖市人民政府药品监督管理部门提交注册申请资料。
国家市场监督管理总局令第48号《体外诊断试剂注册与备案管理办法》第九条 境内第二类体外诊断试剂由省、自治区、直辖市药品监督管理部门审查,批准后发给医疗器械注册证。
不限 NMPA 广东省 江苏省 浙江省 上海市 北京市 福建省 天津市 重庆市 河北省 山西省 吉林省 辽宁省 黑龙江省 陕西省 甘肃省 青海省 山东省 台湾省 河南省 湖北省 湖南省 江西省 安徽省 海南省 四川省 贵州省 云南省

中华人民共和国国务院令第739号《医疗器械监督管理条例》第十六条 申请第二类医疗器械产品注册,注册申请人应当向所在地省、自治区、直辖市人民政府药品监督管理部门提交注册申请资料。
国家市场监督管理总局令第48号《体外诊断试剂注册与备案管理办法》第九条 境内第二类体外诊断试剂由省、自治区、直辖市药品监督管理部门审查,批准后发给医疗器械注册证。

中华人民共和国国务院令第739号《医疗器械监督管理条例》第十三条 “第一类医疗器械实行产品备案管理,第二类、第三类医疗器械实行产品注册管理。”
中华人民共和国国务院令第739号《医疗器械监督管理条例》第十五条 “第一类医疗器械产品备案,由备案人向所在地设区的市级人民政府负责药品监督管理的部门提交备案资料。”

《医疗器械监督管理条例》(中华人民共和国国务院令第739号)四十二条,从事第三类医疗器械经营的,经营企业应当向所在地设区的市级人民政府负责药品监督管理的部门申请经营许可并提交符合本条例第四十条规定条件的有关资料。医疗器械经营许可证有效期为5年。有效期届满需要延续的,依照有关行政许可的法律规定办理延续手续。

(一)有与生产的医疗器械相适应的生产场地、环境条件、生产设备以及专业技术人员;
(二)有能对生产的医疗器械进行质量检验的机构或者专职检验人员以及检验设备;
(三)有保证医疗器械质量的管理制度;
(四)有与生产的医疗器械相适应的售后服务能力;
(五)符合产品研制、生产工艺文件规定的要求;

国家市场监督管理总局令第47号《医疗器械注册与备案管理办法》第八条 境内第二类医疗器械由省、自治区、直辖市药品监督管理部门审查,批准后发给医疗器械注册证。

医疗器械监督管理条例

医疗器械监督管理条例

医疗器械监督管理条例


已有1777次查看

已有1423次查看

已有1366次查看

已有1391次查看
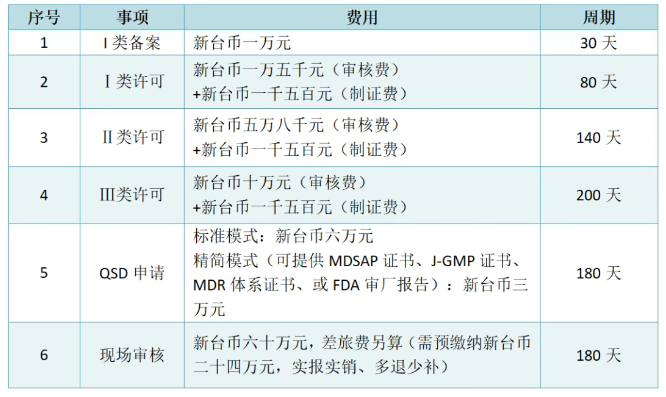
已有772次查看
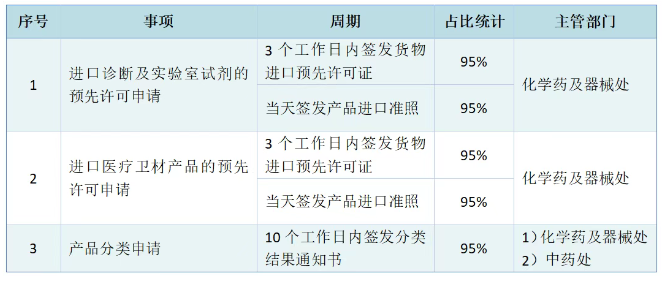
已有642次查看

已有722次查看

已有1154次查看

已有605次查看

已有551次查看

已有707次查看

已有637次查看

已有570次查看

已有647次查看
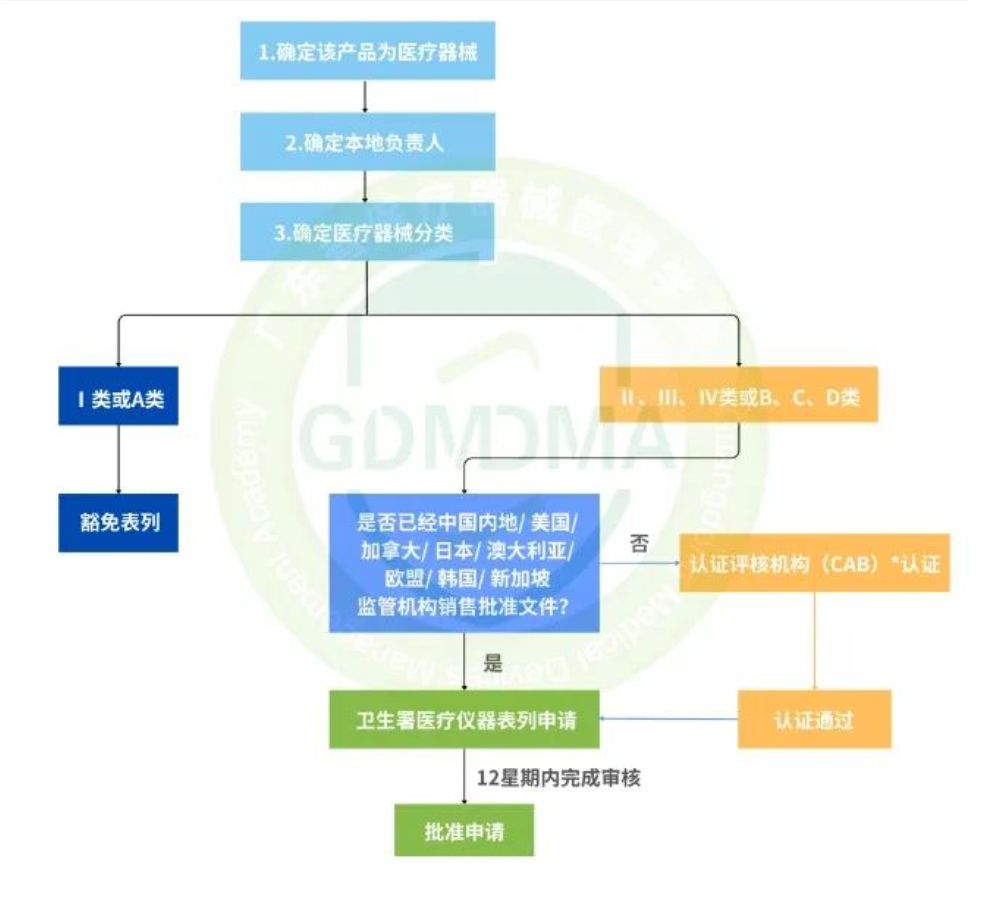
已有977次查看





