成都高端医疗器械产业加速聚势成链
不限 2024 2023 2022 2021 2020 2019 2018 2017 2016 2015 2014 2013 2012 2011 2010 2009 2008 2007 2006


在办理医疗器械生产许可证时,企业不仅需要满足国家相关法规和标准,还需要确保整个流程的顺畅和高效。为了实现省心办理的目标,本文将详细介绍几个关键点,帮助企业更好地应对办理过程中的各种挑战。

人工智能(AI)技术在医学影像领域的发展与应用备受关注。根据 Global Market Insights 报告,2022 年全球医疗 AI 市场规模超过 50 亿美 元,并预计将以超过 29%的年均复合增速增长至 2032 年市 700 亿美元。而2022年全球医疗器械市场的年符合增长率为以5.9%,医疗AI市场增速远超整体医疗器械市场。

FDA建议厂商要进行随机对照试验,尽可能让支持这些研究的间接人员保持盲态。对于涉及外国数据的临床试验,FDA建议厂商在关键研究中使用的美国境外的数据不应超过一半,并将研究地点的入组人数限制在不超过总研究人群的20%。在具有潜在安慰剂效应的研究中,FDA建议使用假对照研究,或者在假对照不可行的情况下使用同步对照组。

最终财政部判定,北京中研海康科技有限公司投诉事项1、2成立(其所投产品为国产产品,符合招标文件要求,本项目评审错误),并责令采购人重新开展采购活动,原中标结果一并被作废。在参与招投标过程中遭遇“小插曲”不奇怪,但是把投标产品国产、进口身份弄错的确实少见,好在最后供应商通过质疑投诉等手段为自己找回了公道。

“一带一路”医疗器械创新与应用联盟秘书长、上海理工大学医疗器械学院院长程云章介绍称,平均来看,国外医疗器械产品的价格是我国同类产品的5至10倍,中亚地区可能成为我国医疗器械企业出海的重要市场。
据介绍,目前我国医疗器械出口中,出口到“一带一路”共建国家的占比约三分之一,且以低值耗材为主,未来向创新产品转变仍有较大的增长空间。

该主题分论坛上,还有中国科学院院士、发展中国家科学院院士李劲松带来的“基因组标签计划—打造生命科学的北斗导航系统”的主题开课,他带领团队大力推动类精子干细胞技术研究与应用,让蛋白质研究有了标准化的在体、实时、动态的研究体系,不仅解决了“很多研究无法重复”的尴尬,也突破了实验动物“卡脖子”困境。

医疗技术的不断发展,医疗器械市场也在不断壮大。对于进口医疗器械来说,其注册要点是确保市场准入和合法销售的重要环节。本文将围绕进口医疗器械注册的要点进行阐述。


已有843次查看

已有748次查看
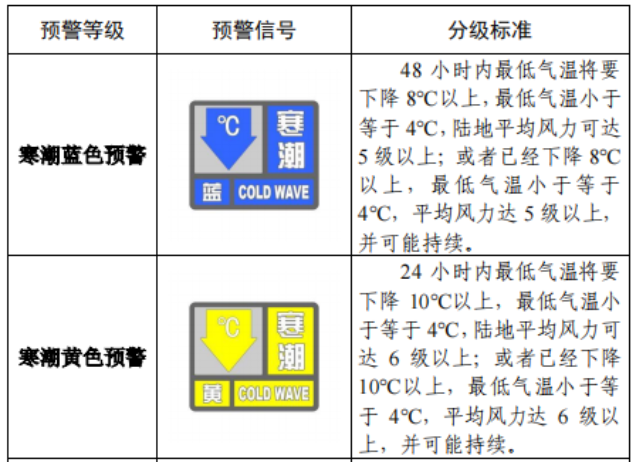
已有768次查看
已有750次查看

已有758次查看

已有862次查看

已有763次查看
已有729次查看
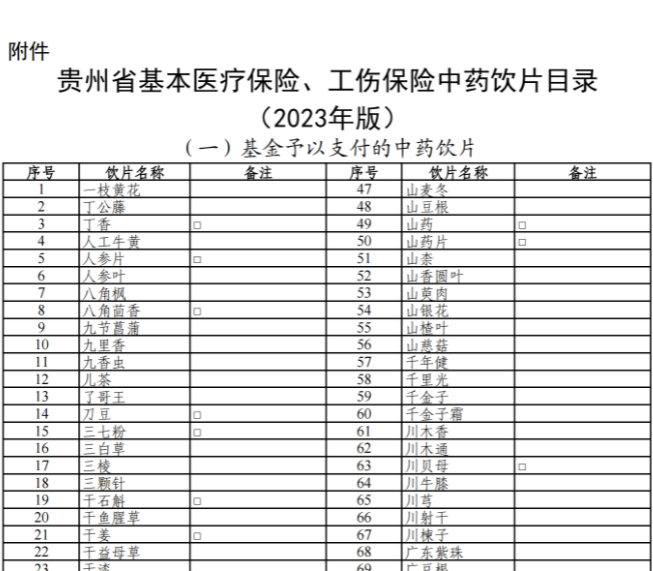
已有750次查看

已有726次查看





