医疗器械产品注册有哪些重要的注意事项?医疗器械产品注册前,企业需要充分了解相关的法规和指导原则。中国国家食品药品监督管理总局(CFDA)是负责医疗器械监管的政府部门,其发布的《医疗器械注册管理办法》和《医疗器械监督管理条例》是指导医疗器械产品注册的基本法规。
医疗器械产品注册是医疗器械上市销售前的重要环节,也是确保产品质量和安全的关键步骤。本文将围绕医疗器械产品注册的注意事项进行阐述,帮助企业更好地了解和遵守相关法规和指导原则。
不限 2024 2023 2022 2021 2020 2019 2018 2017 2016 2015 2014 2013 2012 2011 2010 2009 2008 2007 2006

医疗器械产品注册是医疗器械上市销售前的重要环节,也是确保产品质量和安全的关键步骤。本文将围绕医疗器械产品注册的注意事项进行阐述,帮助企业更好地了解和遵守相关法规和指导原则。

医疗技术的不断发展,医疗器械市场也在不断壮大。对于二类医疗器械来说,其注册证变更的要求是确保市场准入和合法销售的重要环节。本文将围绕二类医疗器械注册证变更的要求进行阐述。

医疗器械注册证是医疗器械生产企业获得合法生产和销售的重要证明文件。如果丢失了医疗器械注册证,需要尽快采取措施进行补办,以确保企业的正常运营和合法性。本文将围绕如何补办医疗器械注册证进行阐述。

“这是对TekniPlex医疗保健的变革性收购,将我们扩大到医疗技术的合同,开发和制造组织(CDMO)部分,”TekniPlex Healthcare首席执行官Chris Qualters说,“我们有能力通过开发工程材料,共同设计组件和组装,使用先进的工艺技术和提供无菌屏障产品与我们的全球客户进行新的医疗技术合作,这使我们能够与他们真正合作,从概念到护理,以帮助改善患者结果”。

一直以来,人们都担心脉搏血氧仪(Pulse Oximetry)的准确性会因为肤色差异而出现偏差。当COVID-19大流行期间,脉搏血氧仪被广泛用于评估病毒对肺部的影响,诊断结果的矛盾出现更加重了这个由来已久的担心。2021年,FDA开始审视这一问题。

医疗器械PMDA注册是指在日本厚生劳动省进行医疗器械上市前申请的过程。PMDA是日本厚生劳动省的英文缩写,负责监管日本的医疗器械市场,对医疗器械的上市前申请进行审批。

医疗器械临床CRO的首要职责是根据医疗器械的特点和目标,设计科学、严谨、可行的临床试验方案。试验方案包括试验目的、试验设计、样本量、观察指标、数据分析方法等。

在欧亚联盟内进行医疗器械注册,企业需要向所在国家的监管部门提交申请材料。这些材料包括医疗器械的技术文件、质量管理体系文件、临床试验报告等。


已有843次查看

已有748次查看
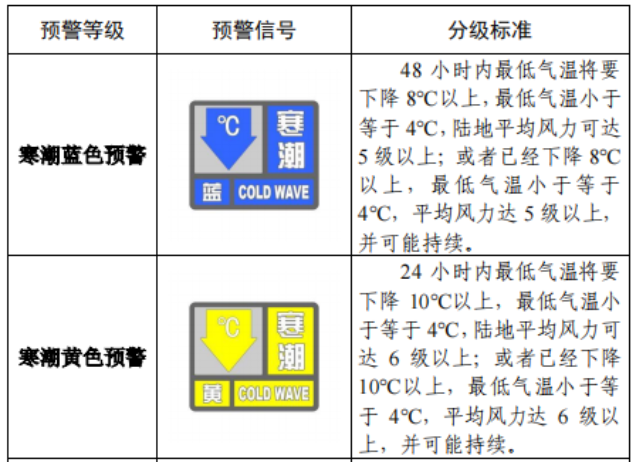
已有768次查看
已有750次查看

已有758次查看

已有862次查看

已有763次查看
已有729次查看
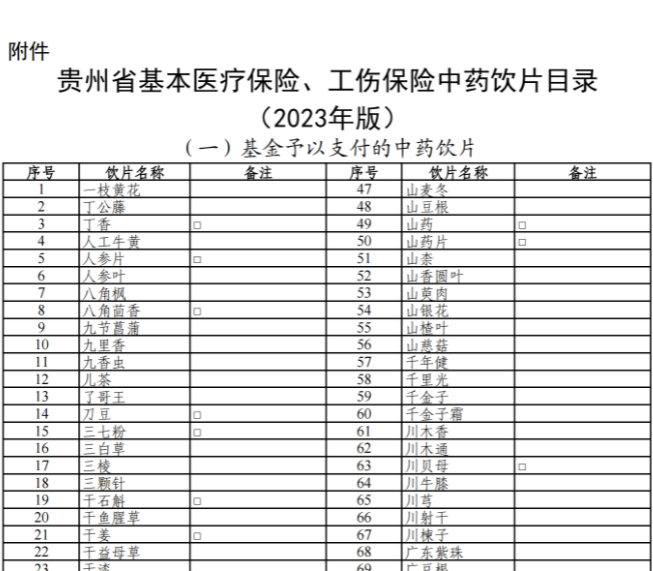
已有750次查看

已有726次查看





