发布时间:2025-05-19 人气:998 作者:天之恒
认证体系
新西兰药物和医疗器械安全管理局(MedSafe)负责新西兰的医疗器械产品注册。新西兰医疗器械注册需要遵循1981年《药品法》(Medicines Act 1981)、1984年《药品条例》(Medicines Regulation 1984)和2003年药品(医疗器械数据库)条例(Medicines (Database of Medical Devices) Regulations 2003)要求。某些医疗器械可能受其他法律影响,如:1992年电力法(Electricity Act 1992),1977年避孕、绝育和堕胎法(Contraception, Sterilisation and Abortion Act 1977),1996年危险物质和新生生物法(Hazardous Substances and New Organisms Act 1996),2016年辐射安全法(Radiation Safety Act 2016),2008年人体组织法案(Human Tissue Act 2008),1998年卫生(针头和注射器)条例(Health (Needles and Syringes) Regulations 1998),1999年就业健康与安全(压力设备、起重机和客运索道)条例(Health and Safety in Employment (Pressure Equipment, Cranes and Passenger Ropeways) Regulations 1999),1989年无线电通信法(Radiocommunications Act 1989)。
产品分类
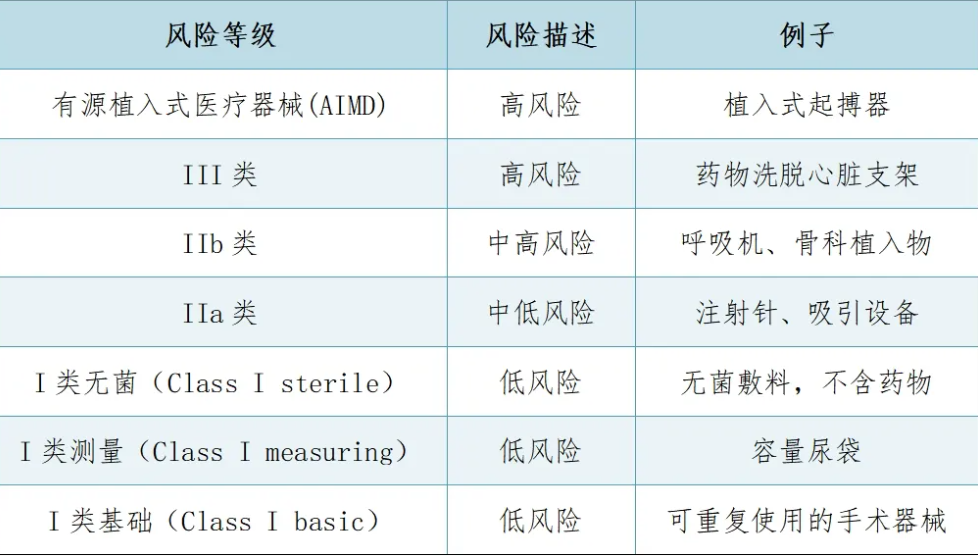
根据全球协调工作组 (GHTF) 的原则,新西兰法规有五个风险等级和两个子等级。这些等级基于医疗器械在按照制造商的预期使用时可能带来的风险。这些等级总结如下:
注册流程
在新西兰,不需要对注册文件进行详细的审查,只需要根据2003年《药品(医疗器械数据库)条例》第7条进行WAND数据库注册和声明就可将这些器械投放新西兰市场。
在新西兰没有设立实体办公场所的公司必须委任一名担保人(sponsor),负责将其医疗器械列入WAND数据库中。新西兰担保人承担确保WAND数据库中信息准确性的职责,也是与MedSafe之间的唯一联络人。
注册周期及费用
Medsafe在收到所有必要文件和信息后,通常需要1-2个月左右可以完成医疗产品的注册。注册周期可能会因为产品类型、复杂性和其他因素而有所差异。所有信息提交至 WAND 数据库均免费。
注册申办平台
在Medsafe官网上的WAND数据库上进行注册 WAND数据库(👈点击跳转)
其他注意事项或特别提醒
新西兰医疗器械的上市列表没有有效期限制。但是,如果某种医疗器械被认为可能对公众构成不可接受的风险,那么它可能会被要求从市场撤回。





