发布时间:2025-05-20 人气:1030 作者:天之恒
新加坡医疗器械监管机构和法规要求
新加坡医疗器械监管机构为卫生科学局(Health Sciences Authority, 简称HSA)。新加坡是一个卫生医疗高度监管的国家,整个医疗器械监管框架法规体系相对完善且严格,
整体要求与欧美国家贴近;其框架主要基于如下三份法案:◆ Health Products Act 2007,简称HPA;◆ Health Products (Medical Devices) Regulations 2010,简称医疗
器械法规2010;◆ ASEAN Medical Devices Directive 2015,即东盟医疗器械指令。
医疗器械产品分类
医疗器械和体外诊断产品根据其风险程度分为4类(A类、B类、C类、D类)。随着器械类别从A类到D类,监管控制强度也逐步增加,A类器械受最少的监管控制(豁免注册
,列名即可),而D类器械则受到最严格的监管控制;
其分类依据指南文件如下:◆ GN-13: Guidance on the Risk Classification of General Medical Devices◆ GN-14: Guidance on the Risk Classification of In Vitro Diagnostic
Medical Devices除了解读以上指南文件初步了解HSA的器械监管分类逻辑,同时您也可以通过医疗器械风险分类工具(👈点击跳转)初步判定您产品的分类。此外,您还
可以检索HSA产品列名数据库(A类)和产品注册库(B类、C类及D类),参考同类产品分类情况进一步确定您产品的分类。◆ HSA产品列名数据库◆ HSA产品注册数据库如
以上方式还不能帮助您确定您产品分类,您可以访问Health Product Classification Form(👈点击跳转)网站申请分类界定。
特别关注:HSA允许某些满足条件的医疗器械以打包方式注册,判定依据指南文件如下:◆ GN-12-1: Guidance on Grouping of Medical Devices for Product Registration -
General Grouping Criteria◆ GN-12-2: Guidance on Grouping of Medical Devices for Product Registration - Device Specific Grouping Criteria
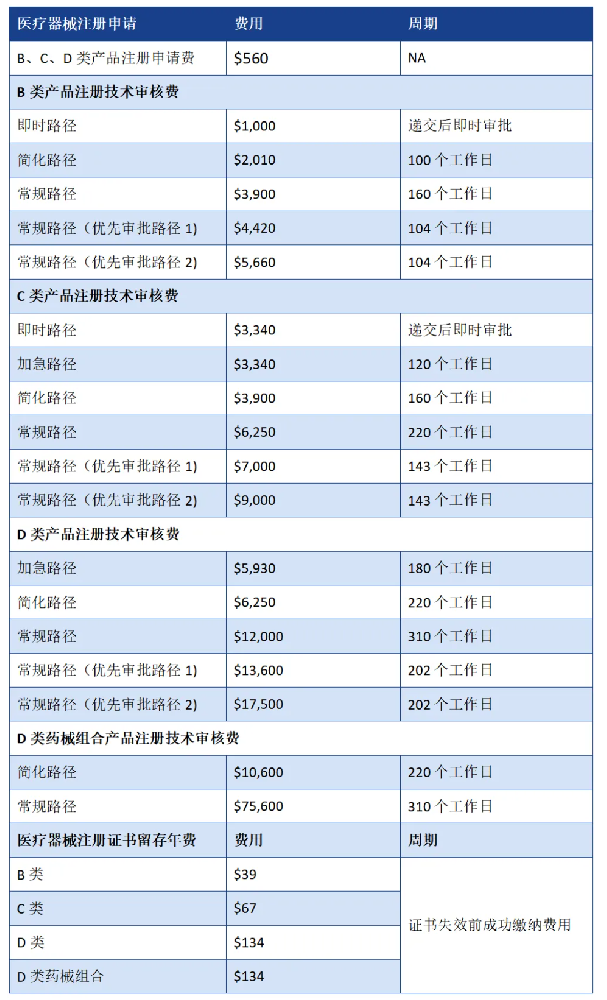
注册周期及费用
制造商许可(Manufacturer’s License):费用为$1,110,周期为10个工作日。产品注册(Product Registration):