江苏省三类医疗器械产品注册核查江苏省政务服务
《境内第三类医疗器械注册质量管理体系核查工作程序(暂行)》(食药监械管〔2015〕63号)
不限 NMPA 广东省 江苏省 浙江省 上海市 北京市 福建省 天津市 重庆市 河北省 山西省 吉林省 辽宁省 黑龙江省 陕西省 甘肃省 青海省 山东省 台湾省 河南省 湖北省 湖南省 江西省 安徽省 海南省 四川省 贵州省 云南省

《境内第三类医疗器械注册质量管理体系核查工作程序(暂行)》(食药监械管〔2015〕63号)

国家市场监督管理总局令第54号其中从事第二类医疗器械经营的,经营企业应当向所在地设区的市级负责药品监督管理的部门备案,并提交符合本办法第十条规定的资料(第七项除外),即完成经营备案,获取经营备案编号。 医疗器械经营备案人应当确保提交的资料合法、真实、准确、完整和可追溯。

(一)申报产品为第二类医疗器械,申请人属于我省辖区,申报产品拟由申请人生产。
(二)申报产品拥有如下知识产权或获奖证明之一: 1.国家级发明奖、科技进步奖; 2.省级科技进步奖二等奖以上; 3.市级科技进步奖一等奖; 4.核心技术发明专利; 5.实用新型专利(与临床应用相关)。
(三)申报产品具有显著的临床应用价值,产品技术为国内领先,或可填补省内该品种医疗器械的空白,或可替代同类进口产品。

(一)临床急需且在本省尚无同品种产品获准注册的医疗器械;
(二)省内已有同类产品上市,但产品供应不能满足突发公共卫生事件应急处理需要的医疗器械;
(三)诊断或者治疗罕见病、恶性肿瘤,且具有明显临床优势的医疗器械;
.............

1、申报注册的产品已经列入《总局关于发布医疗器械分类目录的公告》(2017年第104号)的附件《医疗器械分类目录》,且管理类别为第二类。(注:对新研制的尚未列入分类目录的医疗器械,申请人可以直接向国家食品药品监督管理总局申请第三类医疗器械产品注册,也可以依据分类规则判断产品类别并向国家食品药品监督管理总局申请类别确认后,申请产品注册或者办理产品备案。)
2、申请人应当是在广东省辖区范围依法进行登记的企业(医疗器械注册人制度试点申请人要求另行规定)。
.........

已注册的第二类、第三类医疗器械产品,其设计、原材料、生产工艺、适用范围、使用方法等发生实质性变化,有可能影响该医疗器械安全、有效的,注册人应当向原注册部门申请办理变更注册手续;发生其他变化的,应当按照国务院药品监督管理部门的规定备案或者报告。

依据文号:中华人民共和国国务院令第739号,条款号,第十六条第一款、第二款、第三款,申请第二类医疗器械产品注册,注册申请人应当向所在地省、自治区、直辖市人民政府药品监督管理部门提交注册申请资料。

医疗器械监督管理条例:申请第二类医疗器械产品注册,注册申请人应当向所在地省、自治区、直辖市人民政府药品监督管理部门提交注册申请资料。


已有1777次查看

已有1423次查看

已有1366次查看

已有1391次查看
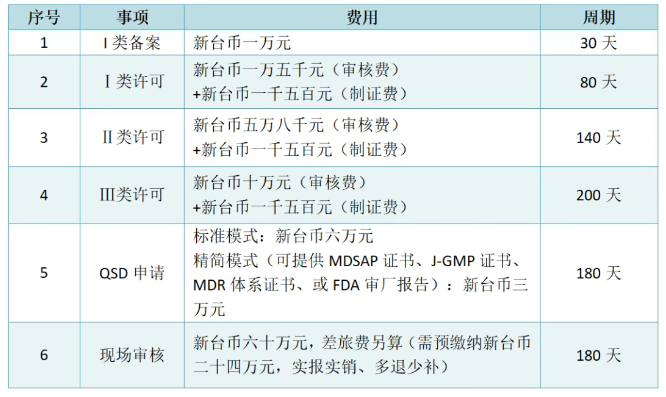
已有772次查看
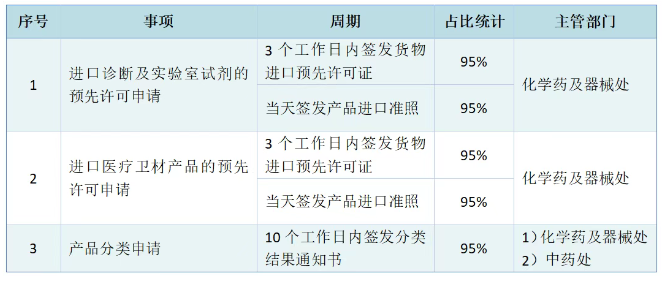
已有642次查看

已有722次查看

已有1154次查看

已有605次查看

已有551次查看

已有707次查看

已有637次查看

已有570次查看

已有647次查看
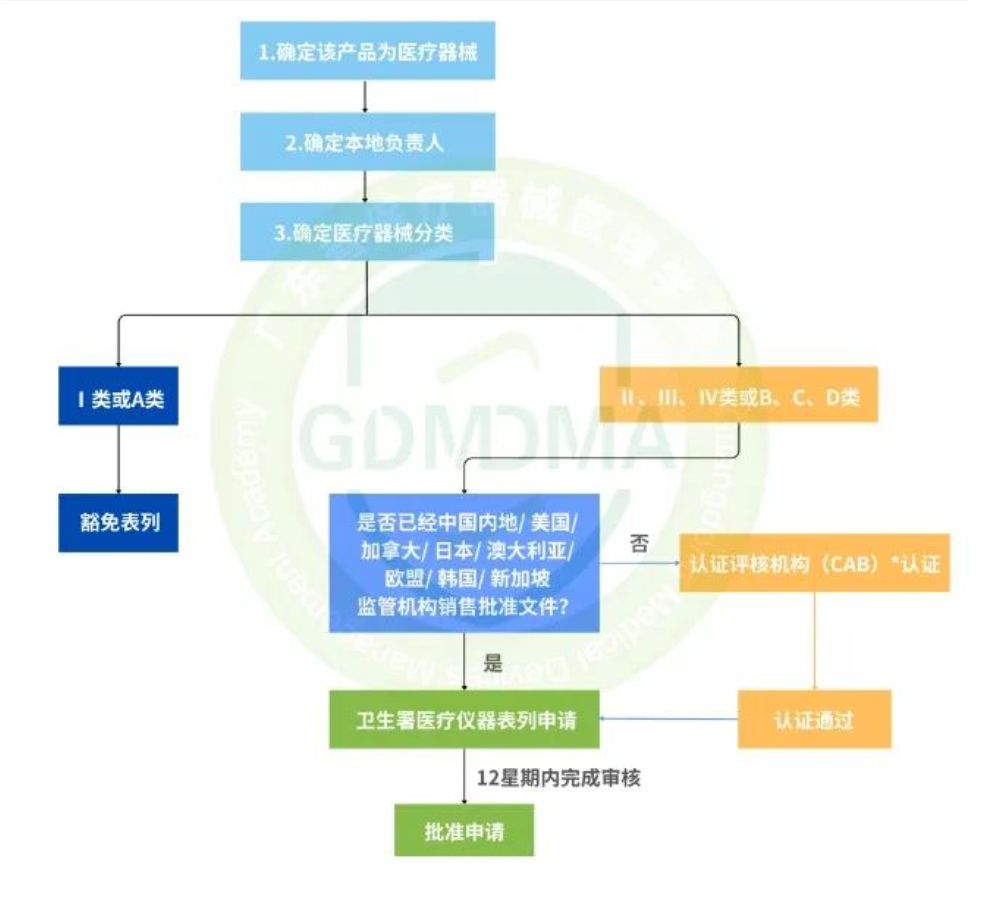
已有977次查看





