【医疗器械注册审批】省局关于2023年10月批准注册第二类医疗器械产品公告本次医疗器械注册审批共批准注册第二类医疗器械产品250个,其中首次注册161个,延续注册89个
2023年10月,广东省药品监督管理局共批准注册第二类医疗器械产品250个,其中首次注册161个,延续注册89个(具体产品见附件)。
不限 2024 2023 2022 2021 2020 2019 2018 2017 2016 2015 2014 2013 2012 2011 2010 2009 2008 2007 2006

2023年10月,广东省药品监督管理局共批准注册第二类医疗器械产品250个,其中首次注册161个,延续注册89个(具体产品见附件)。

一直以来,人们都担心脉搏血氧仪(Pulse Oximetry)的准确性会因为肤色差异而出现偏差。当COVID-19大流行期间,脉搏血氧仪被广泛用于评估病毒对肺部的影响,诊断结果的矛盾出现更加重了这个由来已久的担心。2021年,FDA开始审视这一问题。

从试验设计到数据分析和报告撰写
一、临床试验设计服务
二、临床试验实施服务
三、数据管理与统计分析服务
四、临床试验报告撰写服务
五、监管与沟通服务

医疗器械PMDA注册是指在日本厚生劳动省进行医疗器械上市前申请的过程。PMDA是日本厚生劳动省的英文缩写,负责监管日本的医疗器械市场,对医疗器械的上市前申请进行审批。

医疗器械临床CRO的首要职责是根据医疗器械的特点和目标,设计科学、严谨、可行的临床试验方案。试验方案包括试验目的、试验设计、样本量、观察指标、数据分析方法等。

创新医疗器械注册需要提交完整的注册申请资料,包括产品技术文件、质量管理体系文件、临床试验报告等。这些资料必须真实、准确、完整,才能够通过监管部门的审查。

在欧亚联盟内进行医疗器械注册,企业需要向所在国家的监管部门提交申请材料。这些材料包括医疗器械的技术文件、质量管理体系文件、临床试验报告等。

有一家叫NORDSON Medical (诺信医学)的创新公司和一家叫XPAN(艾克斯畔)的创新公司在穿刺器的创新方面提供了两种不同的新方向,其中Nordson medical创新地将临床刚需的全分离式穿刺器+可视性的穿刺锥+为解决临床筋膜缝合的痛点而诞生的筋膜闭合器做了一个非常巧妙的集成设计,解决了临床中确切的痛点,进行了比较大的创新,发明了一款叫一次性套管穿刺器型筋膜闭合器。


已有843次查看

已有748次查看
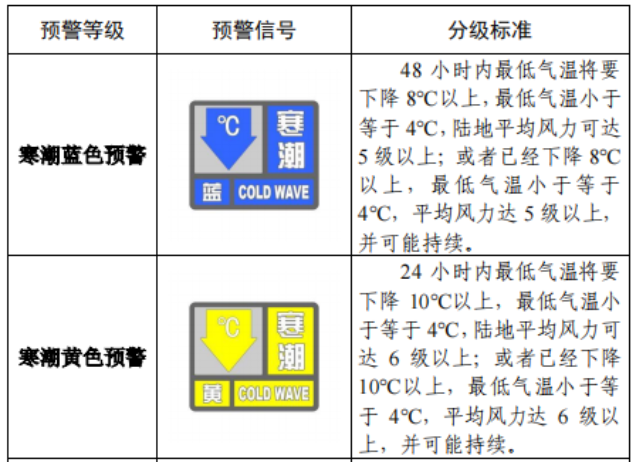
已有768次查看
已有750次查看

已有758次查看

已有862次查看

已有763次查看
已有729次查看
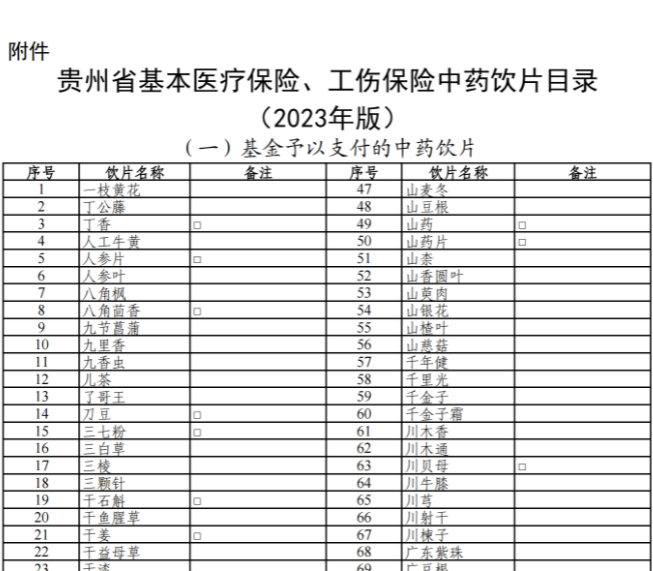
已有750次查看

已有726次查看





