浙江省食品药品监督管理局关于深化药品医疗器械“最多跑一次”改革的若干意见推动药品医疗器械产业创新发展,提升药品医疗器械质量安全水平,为我省“两个高水平”“四个强省”“六个浙江”建设作出积极贡献。
(一)并联审批、能联尽联
(二)多证联办、能合尽合
(三)流程再造、能快尽快
(四)简政提效、能简尽简
(五)激活市场、能优尽优
(六)事中事后、加强监管
不限 NMPA 广东省 江苏省 浙江省 上海市 北京市 安徽省 河北省 山西省 吉林省 辽宁省 黑龙江省 陕西省 甘肃省 青海省 山东省 福建省 台湾省 河南省 湖北省 湖南省 江西省 海南省 四川省 贵州省 云南省 天津市 重庆市
不限 2024 2023 2022 2021 2020 2019 2018 2017 2016 2015 2014 2013 2012 2011 2010 2009 2008 2007 2006

(一)并联审批、能联尽联
(二)多证联办、能合尽合
(三)流程再造、能快尽快
(四)简政提效、能简尽简
(五)激活市场、能优尽优
(六)事中事后、加强监管

根据《网格监管团队“下沉两级”工作制度(试行)》,建立由省、市县(市、区) 监管人员组成的监管团队名单。
组织监管团队开展现场检查,在检查记录表中如实记录现场检查发现的问题。

检查结束时向企业通报检查情况,并由企业负责人在检查记录表上签字确认。检查组撰写检查报告,检查报告如实反应检查全部真实情况处室汇总整理检查记录和检查报告,讨论研究检查结果处理。

为贯彻落实《国务院关于改革药品医疗器械审评审批制度的意见》(国发〔2015〕44号)以及国务院有关行政审批制度改革精神,进一步加强医疗器械注册管理,切实提高审评审批效率,经国家食品药品监督管理总局局务会议研究决定,将下列由国家食品药品监督管理总局作出的医疗器械行政审批决定,调整为由国家食品药品监督管理总局医疗器械技术审评中心以国家食品药品监督管理总局名义作出:

对保障人体健康和生命安全的技术要求,应当制定为医疗器械强制性国家标准和强制性行业标准。对满足基础通用、与强制性标准配套、对医疗器械产业起引领作用等需要的技术要求,可以制定为医疗器械推荐性国家标准和推荐性行业标准。

本办法所称医疗器械召回,是指医疗器械生产企业按照规定的程序对其已上市销售的某一类别、型号或者批次的存在缺陷的医疗器械产品,采取警示、检查、修理、重新标签、修改并完善说明书、软件更新、替换、收回、销毁等方式进行处理的行为。


已有521次查看

已有458次查看
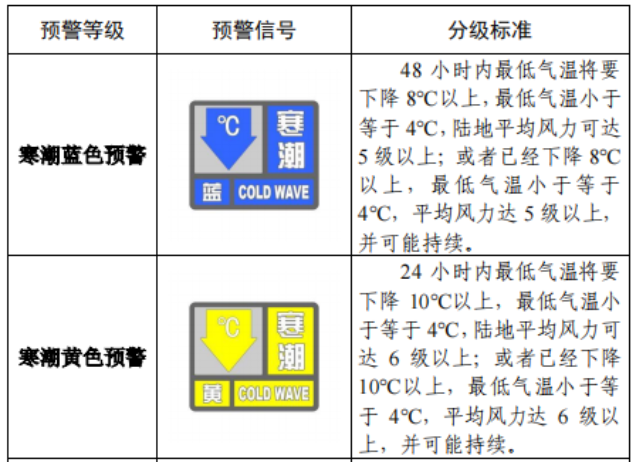
已有488次查看
已有470次查看

已有488次查看

已有588次查看

已有482次查看
已有466次查看
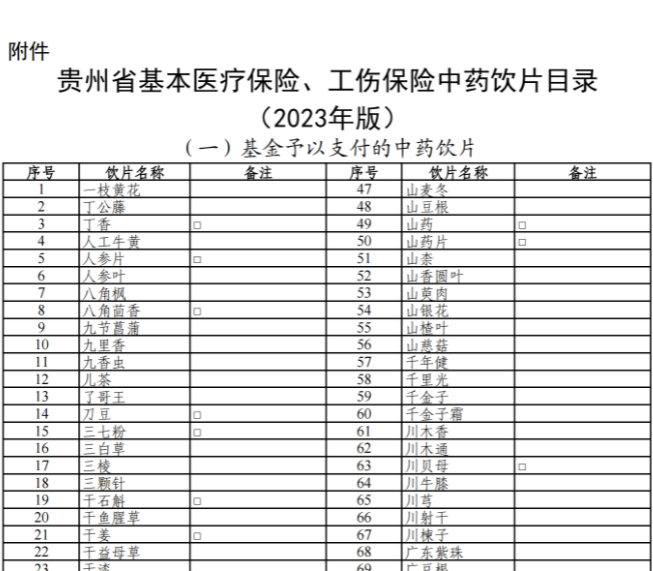
已有465次查看

已有458次查看





