医疗器械临床试验机构备案国家药监局
《医疗器械监督管理条例》(国务院令第680号)第十八条 开展医疗器械临床试验,应当按照医疗器械临床试验质量管理规范的要求,在具备相应条件的临床试验机构进行,并向临床试验提出者所在地省、自治区、直辖市人民政府食品药品监督管理部门备案。
不限 NMPA 广东省 江苏省 浙江省 上海市 北京市 福建省 天津市 重庆市 河北省 山西省 吉林省 辽宁省 黑龙江省 陕西省 甘肃省 青海省 山东省 台湾省 河南省 湖北省 湖南省 江西省 安徽省 海南省 四川省 贵州省 云南省

《医疗器械监督管理条例》(国务院令第680号)第十八条 开展医疗器械临床试验,应当按照医疗器械临床试验质量管理规范的要求,在具备相应条件的临床试验机构进行,并向临床试验提出者所在地省、自治区、直辖市人民政府食品药品监督管理部门备案。

《国家药监局关于发布医疗器械唯一标识系统规则的公告》(2019年 第66号)公告规定,国家局组织建立医疗器械唯一标识数据库,医疗器械注册人/备案人应将产品标识和相关数据上传至医疗器械唯一标识数据库。

《总局办公厅关于规范医疗器械产品分类有关工作的通知》(食药监办械管〔2017〕127号中“(三)标管中心负责对进口及港、澳、台产品的分类界定申请和省级食品药品监督管理部门出具预分类界定意见的分类界定申请组织研究审核”。


已有1313次查看

已有1125次查看

已有1050次查看

已有1104次查看
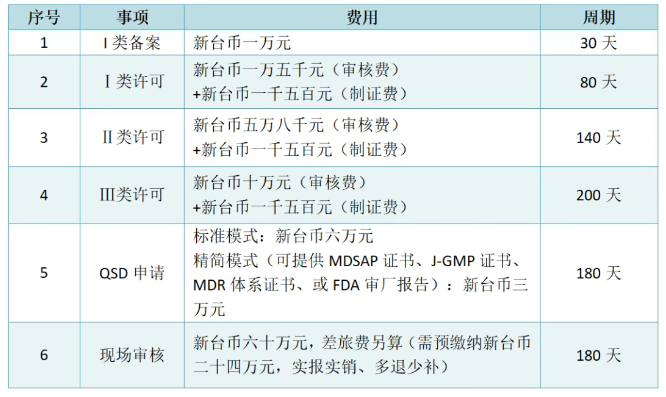
已有179次查看
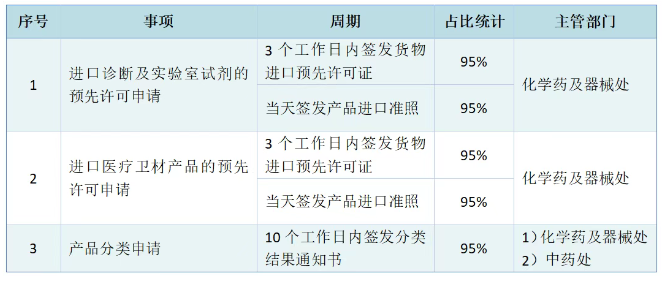
已有149次查看

已有178次查看

已有179次查看

已有161次查看

已有165次查看

已有156次查看

已有152次查看

已有163次查看

已有139次查看
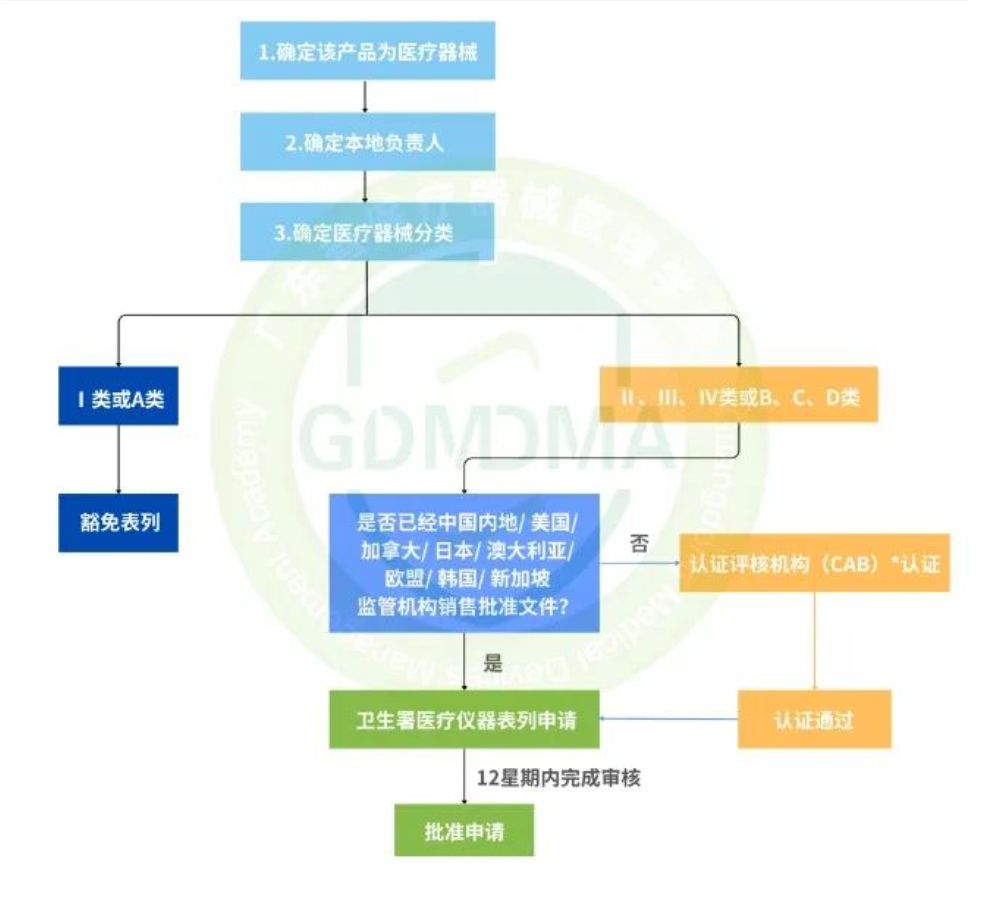
已有217次查看





