医疗器械产品技术要求和注册检验产品技术要求主要包括医疗器械成品的性能指标和检验方法,其中性能指标是指可进行客观判定的成品的功能性、安全性指标以及与质量控制相关的其他指标。在中国上市的医疗器械应当符合经注册核准或者备案的产品技术要求。
申请人或者备案人应当编制拟注册或者备案医疗器械的产品技术要求。第一类医疗器械的产品技术要求由备案人办理备案时提交食品药品监督管理部门。第二类、第三类医疗器械的产品技术要求由食品药品监督管理部门在批准注册时予以核准。
不限 2024 2023 2022 2021 2020 2019 2018 2017 2016 2015 2014 2013 2012 2011 2010 2009 2008 2007 2006

申请人或者备案人应当编制拟注册或者备案医疗器械的产品技术要求。第一类医疗器械的产品技术要求由备案人办理备案时提交食品药品监督管理部门。第二类、第三类医疗器械的产品技术要求由食品药品监督管理部门在批准注册时予以核准。

国家建立医疗器械不良事件监测制度,对医疗器械不良事件及时进行收集、分析、评价、控制。医疗器械生产经营企业、使用单位应当对所生产经营或者使用的医疗器械开展不良事件监测;发现医疗器械不良事件或者可疑不良事件,应当按照国务院食品药品监督管理部门的规定,向医疗器械不良事件监测技术机构报告。

从事医疗器械经营活动,应当有与经营规模和经营范围相适应的经营场所和贮存条件,以及与经营的医疗器械相适应的质量管理制度和质量管理机构或者人员。

2023年9月中旬,规模最大的科技领域并购基金公司Thoma Bravo宣布,将对NextGen Healthcare进行私有化。此次Thoma Bravo将以每股23.95美元的现金收购该公司,总计金额约18亿美元(折合人民币约为131亿元),包括承担相应债务。

总部位于奥地利维也纳(Vienna,Austria)的软包装企业专家Coveris推出了一款适用于医疗器械应用的可回收热成型薄膜Formpeel P,以更可持续的方式实现了与传统医疗包装材料相同水平的功能和安全性。

向我国境内出口第一类医疗器械的境外生产企业,由其在我国境内设立的代表机构或者指定我国境内的企业法人作为代理人,向国务院食品药品监督管理部门提交备案资料和备案人所在国(地区)主管部门准许该医疗器械上市销售的证明文件。

三类医疗器械许可证注册要求包括申请材料要求、场地要求、人员要求、管理制度要求及其他要求。企业在进行三类医疗器械经营之前必须满足这些要求并取得相应的许可证方可开展业务。同时,国家对三类医疗器械经营企业的监管力度也十分严格,因此企业必须重视许可证的申请及后续合规经营工作。

二类医疗器械经营许可证备案需要的时间因具体情况而异,但一般需要在20个工作日左右。企业需要提前了解相关法规和规定,准备好材料,并选择合适的申请时间,以加快备案进程。同时,企业也需要积极配合管理部门的审查和检查工作,确保所经营的医疗器械的安全性和有效性。


已有847次查看

已有751次查看
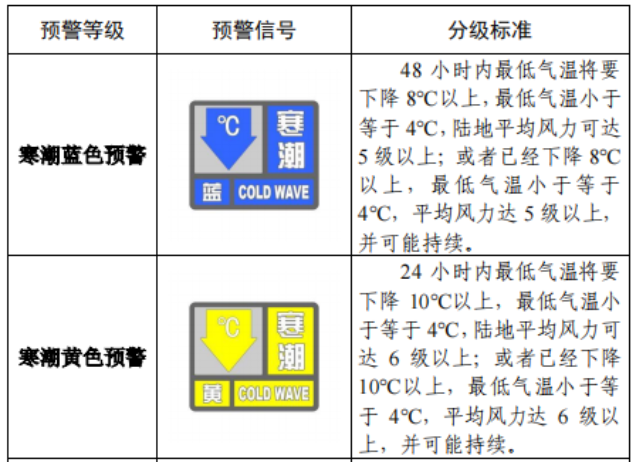
已有774次查看
已有753次查看

已有761次查看

已有864次查看

已有766次查看
已有734次查看
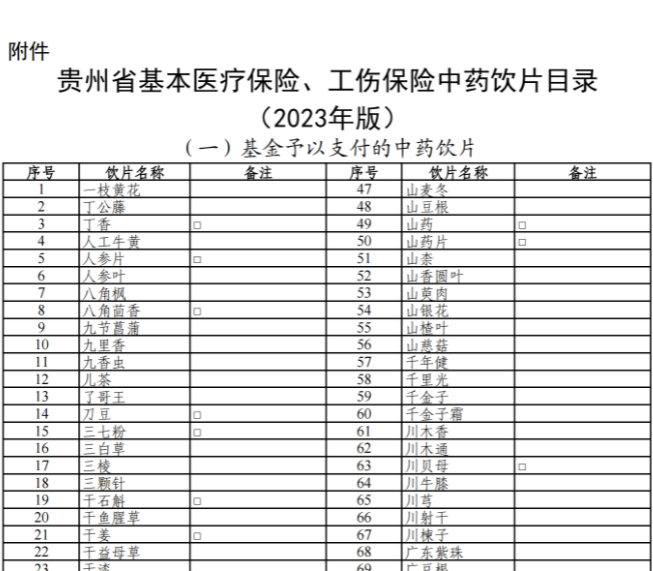
已有755次查看

已有729次查看





