关于印发江苏省医疗器械生产分级监管实施办法的通知(有效)是指根据医疗器械的风险程度以及医疗器械注册人备案人、受托生产企业的质量管理水平
结合医疗器械不良事件、企业监管信用及产品质量投诉状况等因素,将医疗器械注册人备案人、受托生产企业分为不同的级别,按照风险分级、科学监管,全面覆盖、动态调整,落实责任、提升效能的原则,实施属地化分级动态管理的活动。
不限 NMPA 广东省 江苏省 浙江省 上海市 北京市 安徽省 河北省 山西省 吉林省 辽宁省 黑龙江省 陕西省 甘肃省 青海省 山东省 福建省 台湾省 河南省 湖北省 湖南省 江西省 海南省 四川省 贵州省 云南省 天津市 重庆市
不限 2024 2023 2022 2021 2020 2019 2018 2017 2016 2015 2014 2013 2012 2011 2010 2009 2008 2007 2006

结合医疗器械不良事件、企业监管信用及产品质量投诉状况等因素,将医疗器械注册人备案人、受托生产企业分为不同的级别,按照风险分级、科学监管,全面覆盖、动态调整,落实责任、提升效能的原则,实施属地化分级动态管理的活动。

围绕积极践行“争当表率、争做示范、走在前列”光荣使命,深入贯彻落实省第十四次党代会决策部署,推动医药产业创新提质增效,提出了一系列有针对性和可操作性的工作举措,着力促进我省打造全国领先、全球有影响力的医药产业高地。现就《行动方案》有关内容解读如下:

设立了专门的“特殊注册程序”章节,对应急注册程序作出了具体规定,为有效预防、及时控制和消除突发公共卫生事件的危害,确保突发公共卫生事件应急所需医疗器械尽快完成审批,结合我省实际制定有关细化的程序规定也是贯彻落实医疗器械新法律法规的具体要求。

1.诊断或者治疗罕见病、恶性肿瘤且具有明显临床优势,诊断或者治疗老年人特有和多发疾病且目前尚无有效诊断或者治疗手段,专用于儿童且具有明显临床优势,或者临床急需且在我国尚无同品种产品获准注册的医疗器械;
2.省内已有同类产品上市,但产品供应不能满足突发公共卫生事件需要、未纳入应急程序的其他医疗器械;
3.列入国家或省部级科技重大专项、省部级重点研发计划的医疗器械;或申报的医疗器械获得国家级发明奖、科技进步奖、省部级科技进步奖二等奖以上;

“为支持疫情防控,减轻企业负担,对进入医疗器械应急审批程序并与新型冠状病毒相关的防控产品,免征医疗器械产品注册费;对进入药品特别审批程序、治疗和预防新型冠状病毒肺炎的药品,免征药品注册费。

将注册申请人申报小微企业收费优惠政策需提交的资料修订为“上一年度企业所得税纳税申报表(须经税务部门盖章确认)或上一年度有效统计表(统计部门出具);新开办企业,如无上述资料,可提供上一个月的单位社会保险参保缴纳证明(社会保险部门出具)”

① 化学制剂的命名应当符合《中国药品通用名称》(国家药典委员会编)的药品通用名称,新命名的复方制剂,应认真查询数据库,避免同名异方或同方异名的出现;
② 中药制剂的命名应认真查询数据库,避免同名异方或同方异名的出现;
③ 对于仿制已有制剂标准的医疗机构制剂,制剂名称原则上应当与已有的制剂标准中的药品名称一致。

一、各级食品药品监管部门应切实加强对开展药品流通领域计算机远程监管工作的领导,本着高效、快捷、实用的原则,指定专人、成立相应的组织,负责辖区内各药品、医疗器械经营企业远程监管工作的协调指导和监督检查工作。
二、各省辖市食品药品监管部门应建立相应的数据中心,并配备与工作要求相适应的网络服务器、防火墙等硬件设备。各市、县(区)食品药品监督管理部门应配备专用的计算机、视频摄像头、录音、录像、照相等设备。


已有522次查看

已有458次查看
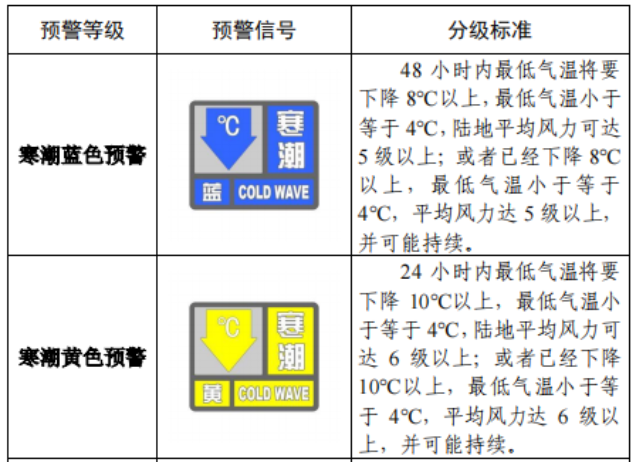
已有489次查看
已有470次查看

已有488次查看

已有588次查看

已有482次查看
已有467次查看
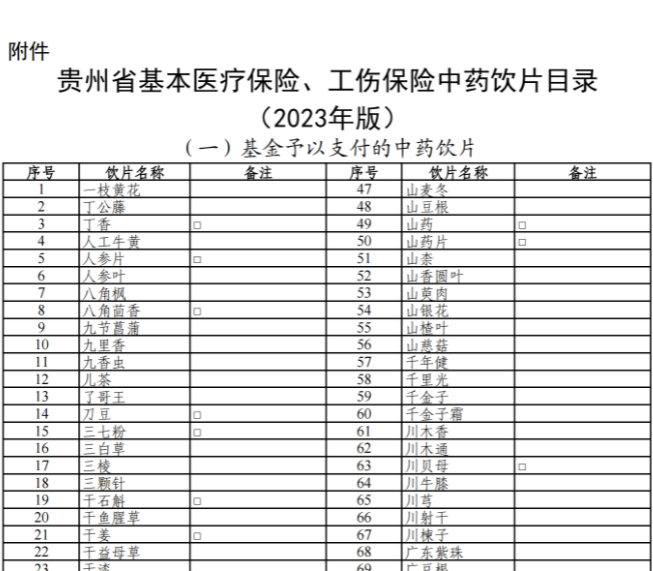
已有465次查看

已有458次查看





